Η ΧΛΩΡΙΩΣΗ ΤΟΥ ΝΕΡΟυ ΩΣ ΜΕΘΟΔΟΣ ΑΠΟΛΥΜΑΝΣΗΣ.
27 ΙΟΥΝΙΟΥ 2020
του Μιχάλη Μεσαναγρενού, Χημικός ΕΚΠΑ
Για αρκετό καιρό σκεφτόμουν πως πρέπει να γράψω λίγα πράγματα για την χλωρίωση του νερού γιατί είναι ένα θέμα που μας αφορά όλους αλλά επίσης βλέπω πως εν έτη 2020 ακόμα δεν έχουμε λύσει βασικά προβλήματα σχετικά με την απολύμανση του νερού
Ξεκινάμε λοιπόν να προσεγγίσουμε το θέμα από την αρχή. Σύμφωνα με τον Παγκόσμιο Οργανισμό Υγείας (WHO)¹ :
κάθε χρόνο πεθαίνουν από μολυσμένο νερό περίπου 485.000 άνθρωποι γιατί οι παθογόνοι μικροοργανισμοί προκαλούν διάρροιες, χολέρα, δυσεντερίες, τύφο κλπ
Σε παγκόσμιο επίπεδο, τουλάχιστον 2 δισεκατομμύρια άνθρωποι χρησιμοποιούν νερό από μολυσμένη πηγή
785 εκατομμύρια άνθρωποι στερούνται βασικές υπηρεσίες πόσιμου νερού
Από τους παραπάνω αριθμούς μπορεί κάποιος να συνειδητοποιήσει το μέγεθος του προβλήματος. Οι οδηγίες που έχει θεσπίσει κάθε κράτος είναι ξεκάθαρες. Το νερό που προορίζεται για ανθρώπινη κατανάλωση πρέπει να είναι απαλλαγμένο από παθογόνους μικροοργανισμούς. Για την Ελλάδα ισχύει πλέον οδηγία Αριθμ. Γ1(δ)/ΓΠ οικ.67322 η οποία θεσπίστηκε ώστε να συμμορφωθεί με την Οδηγία 98/83/ΕΚ του Συμβουλίου της Ευρωπαϊκής Ένωσης και η οποία αντικατέστησε την ΚΥΑ Υ2/2600/2001. Η κύρια διαφορά με την 2600/2001 είναι ότι πλέον ορίζει την συχνότητα και το είδος των αναλύσεων ανάλογα με τον ημερήσιο όγκο διανεμομένου ή παραγομένου νερού.
ΜΕΘΟΔΟΙ ΑΠΟΛΥΜΑΝΣΗΣ
Εδώ και πάρα πολλά χρόνια έχουν αναπτυχθεί μέθοδοι και τεχνικές σχετικά με την απολύμανση του πόσιμου νερού. Κάθε μια μέθοδος όμως έχει τα πλεονεκτήματα και τα μειονεκτήματά της. Η απολύμανση είναι μέθοδος που θανατώνει σε μεγάλο βαθμό τους παθογόνους μικροοργανισμούς. Δεν προκαλεί όμως αποστείρωση δηλαδή δεν θανατώνει κάθε μικροβιακό φορτίο που υπάρχει στο νερό.
Οι κυριότερες μέθοδοι απολύμανσης του νερού είναι:
Χλωρίωση
Υπεριώδης ακτινοβολία UV
Χρήση όζοντος
Χλωραμίνες
Χρήση μικροβιακρατών φίλτρων κ.α.
Η πιο διαδεδομένη μέθοδο απολύμανσης του νερού είναι η χλωρίωση. Κατά τη μέθοδο αυτή γίνεται προσθήκη χλωρίου στο νερό. Υπάρχουν διάφορες επιλογές για αυτό όπως η προσθήκη υποχλωριώδους νατρίου, υποχλωριώδους ασβεστίου, διοξείδιο του χλωρίου και χλωραμίνες


(Α) Χρήση Υποχλωριώδους Νατρίου
Η χρήση υποχλωριώδους Νατρίου είναι η πιο κοινή και διαδεδομένη μέθοδος αυτή τη στιγμή στην Ελλάδα.
Πλεονεκτήματα
Το βασικό πλεονέκτημα της χλωρίωσης είναι η μεγάλη δραστικότητα στο μεγαλύτερο μέρος των παθογόνων μικροοργανισμών.
Ένα άλλο επίσης βασικό πλεονέκτημα είναι η υπολειμματική του δράση αφού μπορεί να παραμείνει για αρκετό καιρό στο νερό οπότε και το προστατεύει σε περιπτώσεις που μένει στάσιμο ή που έρχεται σε επαφή με μια μολυσμένη επιφάνεια όπως ένας παλιός αγωγός νερού
Το ελεύθερο χλώριο λειτουργεί ως οξειδωτικός παράγοντας οξειδώνοντας τόσο το οργανικό φορτίο, αποστρέπει τη δημιουργία αλγών και οξειδώνει το σίδηρο και το μαγνήσιο στα αντίστοιχα οξείδιά τους
Τέλος στα πλεονεκτήματα μπορούμε να προσθέσουμε και το χαμηλό κόστος
Μειονεκτήματα
Εδώ ξεκινάνε τα δύσκολα. Ας πάμε βήμα - βήμα για να μπορέσουμε να εμπεδώσουμε λίγο περισσότερο χημικούς όρους. Το κυριότερο πρόβλημα της χλωρίωσης είναι τα παραπροϊόντα που δημιουργεί.
Το κυριότερο παραπροϊόν της χλωρίωσης είναι τα τριαλογονομεθάνια (THM's) τα οποία είναι οργανικές πτητικές ενώσεις (VOC's, Votalite Organic Compounds). Όταν το νερό έχει οργανικό φορτίο και κυρίως χουμικά, φουλβικά, υδατάνθρακες κλπ αυτά αντιδρούν με το χλώριο και δημιουργούν τα τριαλογονομεθάνια. Τα κυριότερα THM's είναι το χλωροφόρμιο, το βρωμοδιχλωρομεθάνιο, το χλωροδιβρωμομεθάνιο και το βρωμοφόρμιο. Γιατί όμως τόσος λόγος για την χλωρίωση και τα παραπροϊόντα της; Διότι κάποια από τα THM's έχουν χαρακτηρισθεί από τον Διεθνή Οργανισμό (IARC) για την έρευνα για τον καρκίνο ως "ΠΙΘΑΝΑ ΚΑΡΚΙΝΟΓΟΝΑ", κατηγοριοποιήθηκαν δηλαδή ως 2Β. Αυτά είναι το χλωροφόρμιο και το βρωμοδιχλωρομεθάνιο. Εκτός από τον παραπάνω "χαρακτηρισμό", τα THM's έχουν κατηγορηθεί ότι προκαλούν στειρότητα, επιδρούν στο συκώτι και στα νεφρά κ.α.)² . Παραμετρική τιμή ολικών THM's έχει τεθεί τα 100μg/l (100 ppb)
Άλλα παραπροϊόντα της χλωρίωσης είναι η χλωροφαινόλες, χλωριωμένες κετόνες, χλωριωμένες αλδεϋδες, χλωριωμένη φουρανόνη και τα αλογονο-ακετο-νιτρίλια. Για όλα αυτά δεν υπάρχουν αρκετά δεδομένα για να εκτιμηθεί η επικινδυνότητα στον άνθρωπο και επομένως να θέσουν και μέγιστα όρια συγκέντρωσης³
Πολλές φορές μας έχει τύχει να δοκιμάσουμε νερό με έντονη οσμή χλωρίου. Δυστυχώς, σε πολλές περιπτώσεις, ο τρόπος της χλωρίωσης δεν είναι ο ενδεδειγμένος. Η διαδικασία της χλωρίωσης απαιτεί ηλεκτρομηχανολογικό εξοπλισμό, συσκευές μέτρησης και εκπαιδευμένο προσωπικό. Για να δούμε τι εννοώ
Έστω λοιπόν πως πρέπει να χλωριώσουμε μια δεξαμενή νερού. Πρέπει :
να επιλεγεί η κατάλληλη δοσομετρική αντλία η οποία να αποδίδει την απαιτούμενη παροχή που απαιτείται. Αν επιλεγεί μικρότερης απόδοσης αντλία είναι σίγουρο πως δεν θα μπορεί να μας επιφέρει τα επιθυμητά αποτελέσματα
Θα πρέπει να υπάρχει συσκευή μέτρησης υπολειμματικού χλωρίου η οποία να "επικοινωνεί" με την δοσομετρική αντλία και να σταματά ή να ξεκινά όταν η τιμή του χλωρίου είναι αντίστοιχα πάνω ή κάτω από τα επιτρεπτά όρια
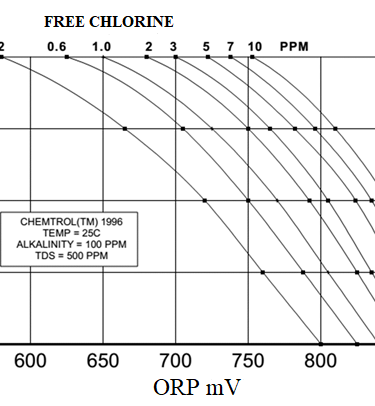
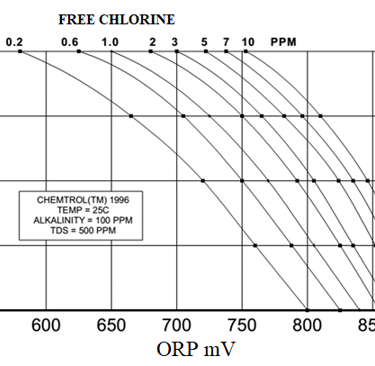
Τέτοιες συσκευές μπορεί να είναι συσκευές που μετράνε απευθείας ελεύθερο χλώριο οι οποίες όμως είναι και πιο ακριβές ή όργανα μέτρησης redox τα οποία σε γενικές γραμμές είναι αξιόπιστα. Υπάρχει αντιστοιχία μεταξύ συγκέντρωσης ελεύθερου χλωρίου και τιμής redox (η οποία όμως εξαρτάται και από το pH και εκεί αρχίζει για μένα η πολυπλοκότητα της κατάστασης) οπότε μπορούν να δοθούν άνω και κάτω όρια σε τιμές redox που να αντιστοιχούν σε τιμές χλωρίου
Ένας σημαντικός παράγοντας σε όλη αυτή τη διαδικασία χλωρίωσης είναι η προληπτική συντήρηση του εμπλεκόμενου εξοπλισμού και αυτό γιατί τυχόν δυσλειτουργίες μπορεί να προκαλέσει μη ικανοποιητική χλωρίωση (να αναφέρω ενδεικτικά παραδείγματα π.χ. βουλωμένα φίλτρα διαλύματος χλωρίου, φθορά σωλήνων της δοσομετρικής, φθορά μεμβρανών της δοσομετρικής, μη σωστή απόκριση του ηλεκτροδίου redox κλπ
Πάρα πολύ σημαντικό είναι η αποθήκευση των δοχείων χλωρίου. Οι εργασίες αυτές κυρίως εκτελούνται από προσωπικό που δεν είναι εκπαιδευμένο και μπορεί εύκολα να μην εκτελεί σωστά μια διαδικασία. Το υποχλωριώδες νάτριο στην υγρή του μορφή έχει την τάση να εξασθενεί με την παραμονή του και κυρίως με την έκθεσή του απευθείας στο ηλιακό φως. Επομένως φανταστείτε ένα διάλυμα 13% υποχλωριώδους Νατρίου μετά την κακή αποθήκευση να έχει συγκέντρωση π.χ. 8%. αυτό σημαίνει ότι δεν θα έχει την ίδια δραστικότητα
Διακριβώσεις οργάνων και συσκευών. Αλήθεια, υπάρχει άραγε πρόγραμμα ελέγχων επιβεβαιώσεων των μετρήσεων και διακριβώσεων των οργάνων μέτρησης χλωρίου στους Δήμους;
Εδώ πρέπει να εμβαθύνω και άλλο σε χημικούς όρους αλλά είναι πολύ σημαντικό γιατί επηρεάζει σημαντικά την αποτελεσματικότητα της απολύμανσης.
Κατά την προσθήκη του υποχλωριώδους νατρίου στο νερό λαμβάνει χώρα η παρακάτω αντίδραση
NaOCl + H2O ↔HOCl +NaOH
στο νερό εμφανίζονται 2 μορφές χλωρίου, το υποχλωριώδες οξύ και το υποχλωριώδες ανιόν. Το υποχλωριώδες οξύ είναι ένα ασθενές οξύ το οποίο διασπάται σε ιόν υδρογόνου (H+) και στο υποχλωριώδες ανιόν σύμφωνα με την παρακάτω χημική εξίσωση:
ΗΟCl ↔ H⁺ + OCl⁻
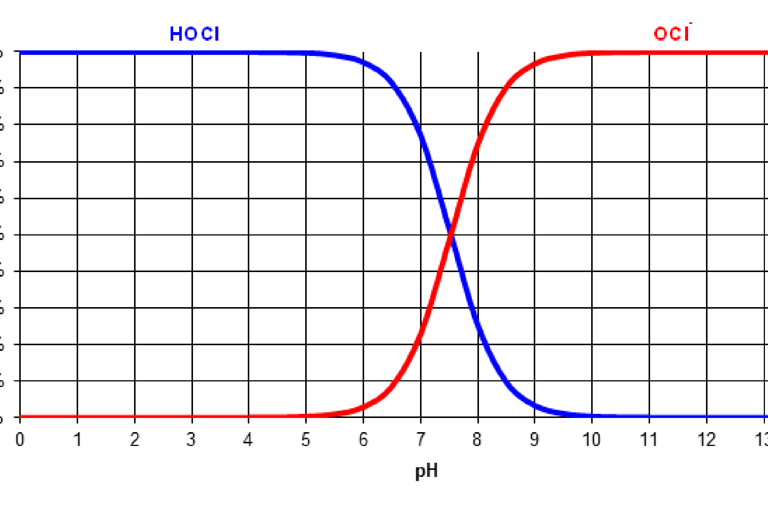
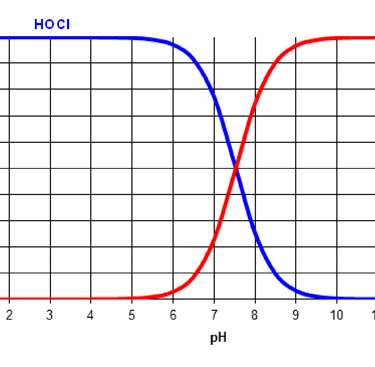
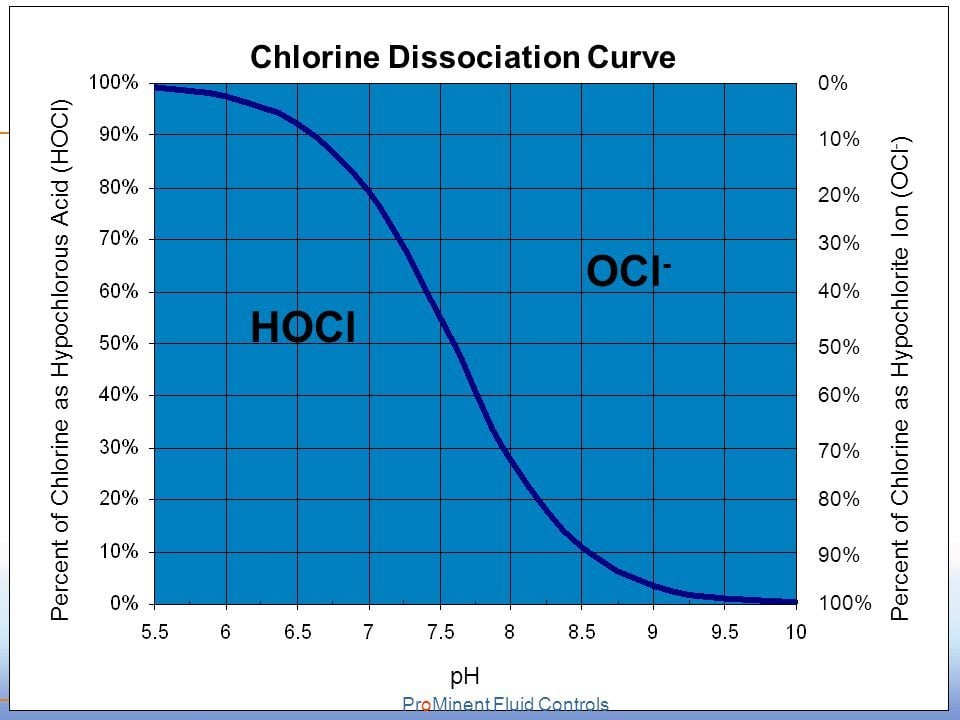
Η διαφορά είναι ότι το υποχλωριώδες οξύ είναι περίπου 80 φορές πιο δραστικό από το υποχλωριώδες ανιόν. Από ποιά μορφή επικρατεί αυτό εξαρτάται από το pH του νερού, όσο πιο όξινο είναι το pH τόσο πιο πολύ επικρατεί το υποχλωριώδες οξύ που είναι πιο δραστικό. Σε τιμές pH άνω του 7.5 επικρατεί η ιοντική μορφή που είναι λιγότερη δραστική. θα πρέπει επομένως να λαμβάνεται υπόψη από τους υπεύθυνους. Στις παρακάτω φωτογραφίες φαίνεται η συσχέτιση HOCl και OCl⁻ σε συνάρτηση με το pH του νερού
Φωτογραφία 1
Διάγραμμα συγκέντρωσης HOCl και OCl- σε συνάρτηση με το pH
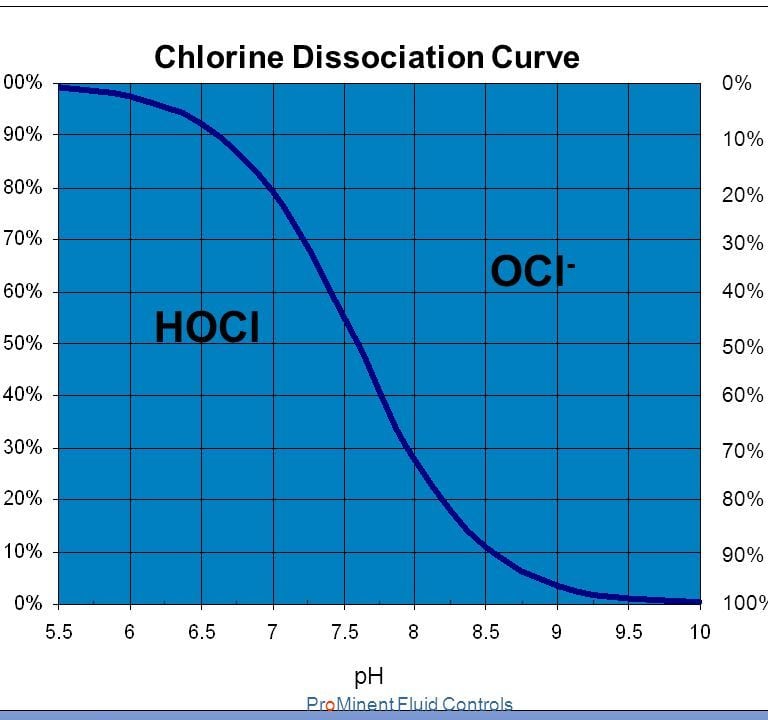
Φωτογραφία 2
Αναλογία HOCL & OCl- σε σχέση με το pH του νερού
(Β) ΧΡΗΣΗ ΔΙΟΞΕΙΔΙΟΥ ΤΟΥ ΧΛΩΡΙΟΥ
Τα τελευταία χρόνια έχει αναπτυχθεί αρκετά η μέθοδος χλωρίωσης με χρήση διοξειδίου του χλωρίου (ClO2). Η εξίσωση που λαμβάνει χώρα είναι :
5NaClO2+4HCl → 4ClO2+5NaCl+2H2O
Οι συγκεντρώσεις κυμαίνονται από 0,2-0,3 mg/l και χρόνος επαφής 5 λεπτά. Η μέθοδος αυτή παρέχει αρκετά πλεονεκτήματα σε σχέση με το υποχλωριώδες νάτριο αλλά έχει και δυνατά μειονεκτήματα. Ας τα εξετάσουμε :
Πλεονεκτήματα
Είναι 2,5 φορές πιο δραστικό από το υποχλωριώδες νάτριο
Χρειάζεται λιγότερος χρόνος επαφής σε σχέση με τα άλλα χημικά
Δεν παράγονται τριαλογονομεθάνια (THM's) και χλωραμίνες
Η δραστικότητά του δεν επηρεάζεται από το pH
Δεν επιδρά αρνητικά στη γεύση και στην οσμή
Έχει μεγάλη αποτελεσματικότητα στην καταπολέμηση των biofilms σε σχέση με τα άλλα χημικά
Δεν αλλοιώνεται με την πάροδο του χρόνου όπως συμβαίνει με το υποχλωριώδες νάτριο
Μειονεκτήματα
Μεγάλο κόστος εγκατάστασης και λειτουργίας
Είναι ιδιαίτερα ασταθές και πρέπει να παρασκευάζεται στο σημείο χρήσης
σε συγκεντρώσεις άνω του 30% είναι εκρηκτικό
Παράγονται χλωριώδη ανιόντα και χλωρικά ανιόντα τα οποία μεθαιμογλοβιναιμία και για το χλωριώδες ανιόν αιμολυτικά αναιμία
ΑΛΛΕΣ ΣΗΜΑΝΤΙΚΈΣ ΠΑΡΑΤΗΡΗΣΕΙΣ
(α). Ένας άλλος παράγοντας που επηρεάζει την αποτελεσματικότητα της χλωρίωσης είναι η θολότητα του νερού. Τα σωματίδια που προκαλούν θολότητα λειτουργούν ως "κρυψώνες" για τα βακτήρια. Εκπληκτικό;
(β). Το υπολειμματικό χλώριο ως έχει δεν προκαλεί βλάβες στον άνθρωπο διότι εξουδετερώνεται από το σάλιο και τα γαστρικά υγρά
(γ). Αναφέρθηκα πιο πάνω ότι ο ελάχιστος χρόνος επαφής του χλωρίου με το νερό για να είναι αποτελεσματική η απολύμανση είναι 15 λεπτά. Αυτό ποικίλει ανάλογα τα βακτήρια και τους ιούς που μπορεί να περιέχει. Έχει βρεθεί ότι για την θανάτωση του E.Coli 0157 ο χρόνος επαφής είναι μικρότερος από 1 λεπτό, για την θανάτωση του ιού της Ηπατίτιδας Α περίπου 16 λεπτά ενώ για τη θανάτωση του κρυπτοσποριδίου απαιτείται χρόνος επαφής 6,7 μέρες
(δ). Το υποχλωριώδες οξύ είναι 80 φορές πιο δραστικό από το υποχλωριώδες ανιόν στην καταστροφή των Ε.Coli και 300-500 φορές πιο δραστικό για την καταστροφή των κυστών Entamoeba histolytica και Giardia
ΜΕΘΟΔΟΙ ΜΕΤΡΗΣΗΣ ΥΠΟΛΕΙΜΜΑΤΙΚΟΥ ΧΛΩΡΙΟΥ
Για την μέτρηση του ελεύθερου χλωρίου χρησιμοποιούνται αρκετές μέθοδοι :
Μέτρηση με DPD. Στο δείγμα που λαμβάνεται προστίθεται αντιδραστήριο το οποίο χρωματίζει το δείγμα ροζ σε περίπτωση παρουσίας ελεύθερου χλωρίου. Η ένταση του χρώματος είναι ανάλογη της συγκέντρωσης. Όσο πιο έντονο είναι το χρώμα τόσο μεγαλύτερη η περιεκτικότητα του ελεύθερου χλωρίου. Στη συνέχεια συγκρίνεται με πρότυπα χρώματα και γίνεται η αντιστοίχιση με την συγκέντρωση. Στην φωτογραφία 3 φαίνεται ένα τέτοιο κιτ. Πλεονεκτεί ότι είναι πολύ φθηνή μέθοδος και πολύ γρήγορη αλλά η ακρίβεια του αποτελέσματος είναι μικρή.
Μέτρηση με φορητό όργανο μέτρησης χρώματος. Η διαδικασία είναι η ίδια με την παραπάνω μέθοδο αλλά το δείγμα τοποθετείται σε φορητό όργανο το οποίο μετράει το χρώμα και έτσι υπολογίζει με ακρίβεια την συγκέντρωση του υπολειμματικού χλωρίου. Είναι πιο ακριβής μέθοδος σε σχέση με την 1 αλλά δίνει σαφώς πιο ακριβή αποτελέσματα (Φωτογραφία 4).
in line όργανα. Εδώ πλέον το κόστος είναι αρκετά μεγαλύτερο όμως η μέτρηση του χλωρίου είναι in line δηλαδή μετράει σε πραγματικό χρόνο το ελεύθερο χλώριο και συνεχώς καθώς λαμβάνει συνέχεια δείγμα από ένα σημείο. Με αυτό τον τρόπο έχουμε συνεχείς μετρήσεις που αν συνδυαστούν με όργανα ειδοποίησης π.χ. φάρο ή σειρήνα τότε μπορεί κάποιος να ενημερώνεται αμέσως αν οι τιμές είναι εκτός των ορίων που έχουν καθορισθεί (φωτογραφία5).
Όργανα redox. Αυτά είναι όργανα (κυρίως ηλεκτρόδια) τα οποία τοποθετούνται σε κάποιο σημείο ενός σωλήνα ή μιας δεξαμενής και μετράνε redox. Οι τιμές redox είναι ανάλογες των συγκεντρώσεων του ελεύθερου χλωρίου και από πίνακες υπολογίζεται προσεγγιστικά η τιμή του υπολειμματικού χλωρίου. Είναι σχετικά φθηνή μέθοδος αλλά μειονεκτεί στην ακρίβεια αλλά και στο γεγονός ότι η αντιστοίχιση redox-υπολειμματικού χλωρίου μεταβάλλεται με τις αλλαγές του pH. Αν επομένως το pH του νερού αλλάζει τότε δεν μπορεί με ακρίβεια να υπολογίζουμε την τιμή του χλωρίου. Στην φωτογραφία 6 φαίνονται σχετικές καμπύλες αντιστοίχισης.
ΟΡΙΑ ΥΠΟΛΕΙΜΜΑΤΙΚΟΥ ΧΛΩΡΙΟΥ
Η Νομοθεσία δεν καθορίζει συγκεκριμένα όρια υπολειμματικού χλωρίου. Είναι όμως κοινά αποδεκτό πως η χλωρίωση στο νερό κυμαίνεται από 0,3 mg/l (ppm) - 1mg/l. Σε τιμές μικρότερες από 0,2 mg/l δεν είναι αρκετή η απολυμαντική του δράση ενώ σε τιμές άνω του 1 ppm το χλώριο δίνει γεύση και οσμή στο νερό
ΠΗΓΕΣ:
[1] https://www.who.int/news-room/fact-sheets/detail/drinking-water
[2] Απολύμανση νερού - Δρ. Μανώλης Κοκκινάκης
[3] Απολύμανση πόσιμου νερού - Μάρκος Σκληβανιώτης
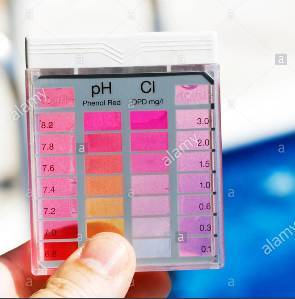
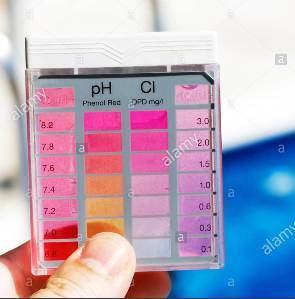
Φωτογραφία 3
απλό κιτ μέτρησης Cl (πηγή: alamy.com)


Φωτογραφία 4
Φορητό όργανο μέτρησης χρώματος HACH για μετρήσεις χλωρίου


Φωτογραφία 5
in line συσκευή μέτρησης χλωρίου σε νερά